PINCHA EN LA IMAGEN
Debido a sus propiedades magnéticas, luminiscentes y electroquímicas únicas, estos elementos ayudan a que muchas tecnologías rindan con peso reducido, emisiones reducidas y consumo de energía; o darles una mayor eficiencia, rendimiento, miniaturización, velocidad, durabilidad y estabilidad térmica. Los productos y tecnologías de tierras raras ayudan a impulsar el crecimiento económico global, mantener altos estándares de vida e incluso salvar vidas.
De hecho, en términos de su abundancia en la corteza terrestre, los REE no son particularmente raros. En promedio, como proporción de la corteza continental de la Tierra, el Cerio (Ce) es el más abundante, con 43 partes por millón (ppm), seguido por el lantano (20 ppm) y el neodimio (Nd, 20 ppm). El REE más raro es el tulio (Tm, 0.28 ppm), excepto el prometio (Pm) que está prácticamente ausente, ya que es radioactivo con una vida media corta. El itrio se produce a 19 ppm. Por lo tanto, sus abundancias generales no son diferentes de muchos otros elementos importantes como el litio (17 ppm), el germanio (1.3 ppm), el cobre (27 ppm), el estaño (1.7 ppm) y el uranio (1.3 ppm).
 Wikipedia y monazitaMonacita
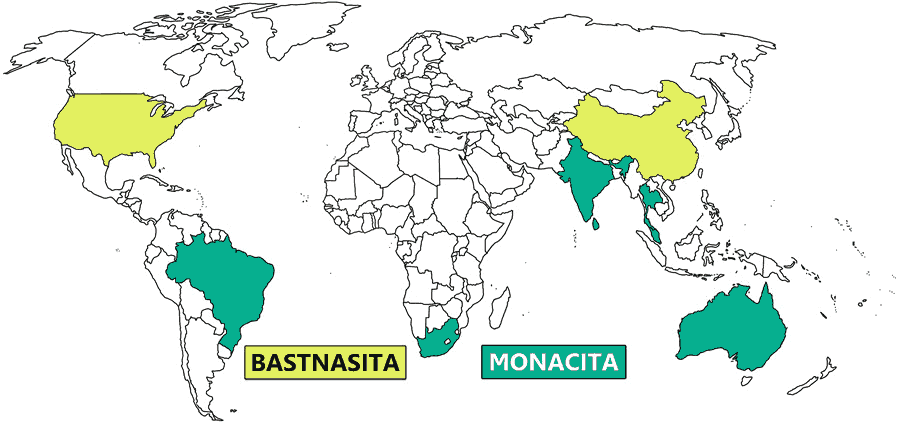
Wikipedia y monazitaMonacita Wikipedia. Los depósitos de Bastnasita en China y los Estados Unidos constituyen el mayor porcentaje del los recursos económicos mundiales de tierras raras, mientras que los depósitos de monacita en Australia, Brasil, China, India, Malasia, Sudáfrica, Sri Lanka, Tailandia y los Estados Unidos constituyen el segundo segmento más grande.
Wikipedia. Los depósitos de Bastnasita en China y los Estados Unidos constituyen el mayor porcentaje del los recursos económicos mundiales de tierras raras, mientras que los depósitos de monacita en Australia, Brasil, China, India, Malasia, Sudáfrica, Sri Lanka, Tailandia y los Estados Unidos constituyen el segundo segmento más grande.
La mayoría de los recursos restantes son la apatita, la queralita, el eudialyte, la loparita, las fosforitas, las arcillas que contienen tierras raras (adsorciónAdsorción (química)La adsorción es la adhesión de átomos, iones o moléculas de un gas, líquido o sólido disuelto a una superficie. Este proceso crea una película de adsorbato en la superficie del adsorbente. Este proceso difiere de la absorción, en la que un fluido (el absorbente) se disuelve o penetra en un líquido o sólido (el absorbente), respectivamente. La adsorción es un fenómeno de superficie, mientras que la absorción involucra todo el volumen del material, aunque la adsorción a menudo precede a la absorción. El término sorción engloba ambos procesos, mientras que desorción es lo contrario. Wikipedia de iones), la monacita secundaria, las soluciones de uranio gastadas y la xenotime. Se cree que los recursos no descubiertos son muy grandes en relación con la demanda esperada. Esto según el Resumen de productos minerales del Estudio Geológico de los Estados Unidos en 2017.
NÚMERO ATÓMICO → 57
PESO ATÓMICO → 138,90547
PUNTO DE FUSIÓN → 920 °C
COLOR → BLANCO PLATEADO
PUNTO DE EBULLICIÓN → 3464 °C
FASE → SÓLIDO
ESTRUCTURA CRISTALINA → HEXAGONAL

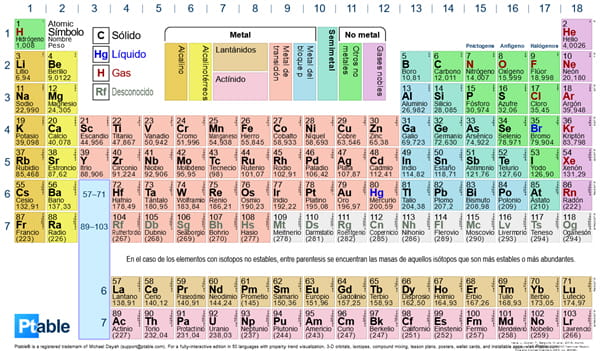
El lantano es el primero de la secuencia de 15 elementos que colectivamente se conocen como «lantánidos», y que tradicionalmente se colocan bajo el cuerpo principal de la tabla periódica en una o dos franjas (la otra, situado justo debajo, es la secuencia de actínidos). La secuencia comprende desde el lantano (número atómico 57) al lutecio (número atómico 71), aunque en rigor el lutecio no es un lantánido, pero se incluye en la serie por su semejanza química con los lantánidos «genuinos». Los lantánidos se colocan al pie de la tabla solamente por conveniencia, para impedir que la tabla acabe teniendo un formato alargado con un ancho de 15 elementos más.
Los lantánidos se conocen a veces como «metales de tierras raras», aunque el término es obsoleto. Cuando se descubrieron, estos elementos eran realmente raros en comparación con los otros metales sólidos de la época. Hoy en día, sin embargo, son relativamente abundantes en comparación con los otros elementos conocidos. El lantano, por ejemplo, es tres veces más común que el plomo y el estaño juntos, pues se encuentra en la corteza de la tierra con una concentración de 32 ppm.
Los lantánidos se agrupan en una familia de elementos debido a la semejanza de sus propiedades químicas. Esto es insólito para una colección de elementos dispuestos en una franja horizontal de la tabla periódica; normalmente, las similitudes químicas se manifiestan en elementos que ocupan el mismo grupo vertical. En el caso de los lantánidos, el parecido se debe al que todos estos elementos tienen el mismo número de electrones en su órbita exterior, y por lo general son estos electrones los que interactúan con otros átomos y, por tanto, son responsables de las propiedades químicas del elemento. Cada uno de los elementos Lantánidos tienen un número distinto de electrones en total, pero, a medida que aumentan el número atómico, estos electrones adicionales se añaden órbitas interiores. En consecuencia, son los mismos tres electrones más externos los que interaccionan con el resto del mundo. Esta es la razón de que las propiedades químicas de todos los lantánidos se parezca mucho.
El lantano fue descubierto en 1839 por el químico sueco Carl Gustav MosanderCarl Gustaf Mosander Wikipedia, algo que, dado su parecido con los otros elementos de la secuencia, no fue hazaña baladí para su época. Mosander calentó nitrato de cerio (un elemento que se había descubierto en 1803) para obtener óxido de cerio. Luego añadió ácido nítrico y llevó el líquido a ebullición para quedarse con el nitrato del nuevo elemento, al cual, siguiendo el consejo de un amigo, llamo «lantano» por el griego lathaneim, que significa «oculto».
Wikipedia, algo que, dado su parecido con los otros elementos de la secuencia, no fue hazaña baladí para su época. Mosander calentó nitrato de cerio (un elemento que se había descubierto en 1803) para obtener óxido de cerio. Luego añadió ácido nítrico y llevó el líquido a ebullición para quedarse con el nitrato del nuevo elemento, al cual, siguiendo el consejo de un amigo, llamo «lantano» por el griego lathaneim, que significa «oculto».
Por aquel entonces, el nombre se podría haber referido a la poca abundancia de estas «tierras raras»; hoy, en cambio, representa mejor el parecido de los elementos, que hace que resulte tan difícil separar los unos de otros cuando se extraen de la tierra con sus minerales. No hay ningún mineral que contenga únicamente lantano, sino un conjunto de minerales que contienen casi todos los lantánidos. No es de extrañar, pues, que esto haya llevado a cierta confusión cada vez que alguien declaraba haber descubierto un nuevo elemento Lantánidos cuando, por ejemplo, la mezcla de dos elementos se ha confundido con un solo elemento nuevo.
En su estado puro, es un metal blando, de color blanco plateado, que se oxida con facilidad en contacto con el aire. El metal en sí no fue aislado hasta 1923. Nunca se encuentra en la naturaleza en su estado puro, sino dentro de dos minerales, la monacita y la bastnasita. Estos minerales contienen casi todos los lantánidos, pero hasta el 38 % de su contenido corresponde a lantano. La bastnasita es el mineral más rico en elemento, pero durante años la monacita fue mucho más común, hasta que en 1949 se descubrieron grandes cantidades de bastnasita en la mina de Mountain Pass en California (Estados Unidos). Desde entonces se ha descubierto en otros depósitos en África y China.
Las reservas mundiales de elementos lantánidos se estiman en total en unos 110 millones de toneladas, mientras que se extraen del suelo cada año unas 70 000 toneladas. A causa de lo complejo de la separación (que se debe al parecido químico entre estos elementos), la mayor parte ser usado en forma de aleaciones (o mischmetal, del alemán «metal mezclado»), en las proporciones en que aparezcan en la mena. Esta proporción suele ser del 50 % de cerio, 25 % de lantano y 15 % de neodimio, mientras que el resto de los lantánidos comprenden el 10 % restante. En términos generales los lantánidos más pesados son menos comunes porque se han hundido en el manto terrestre.
El lantano tiene muchas aplicaciones comerciales: el mischmetal con hierro se usa para fabricar el «pedernal» de los mecheros; y los coches híbridos, como el Toyota Prius™ , usa muchos kilogramos de lantano en sus baterías de níquel-hidruro. Podría haber nuevas aplicaciones en la generación limpia de electricidad: una aleación de lantano y níquel posee la curiosa propiedad de poder absorber grandes cantidades de gas hidrógeno (hasta 400 veces su propio volumen). El hidrógeno es uno de los candidatos a combustible del futuro, pues podría usarse para almacenar y liberar electricidad. A diferencia de una batería que tarda horas en cargarse, un coche podría repostar en el mismo tiempo que hoy se tarda en llenar el depósito de gasolina, y el único producto de la combustión sería agua, que se libera al mismo tiempo que la electricidad.
El lantano también es efectivo en la neutralización de fósforo en un contexto biológico. Por esta razón se utiliza en estanques, donde el fósforo promueve el crecimiento de algas indeseadas. Por otro lado, el carbonato de lantano se usa para tratar problemas renales causados por un exceso de fósforo en la sangre.
El lantano también se puede añadir al vidrio para mejorar sus propiedades ópticas, aumentando su índice de refracción y haciendolo más resistente a la corrosión, y también a hierro para hacerlo más duradero y deformable.
También ha tenido algunas aplicaciones excepcionales. Por ejemplo, fue el descubrimiento de lantánidos inesperados en una muestra de uranio lo que, en 1938, condujo a Otto HahnOtto Hahn Wikipedia y a Lise MeitnerLise Meitner
Wikipedia y a Lise MeitnerLise Meitner Wikipedia al descubrimiento de la fisión nuclear: los átomos de uranio se fisionasban (se rompían) formando átomos de otros elementos, algunos de los cuales eran lantánidos.
Wikipedia al descubrimiento de la fisión nuclear: los átomos de uranio se fisionasban (se rompían) formando átomos de otros elementos, algunos de los cuales eran lantánidos.
Hay dos isótopos naturales del lantano, con 138 y 139 partículas en el núcleo. El La-139 es estable, mientras que La-138 es radiactivo, con una vida media de 100.000 millones de años. Hay otros 38 isótopos artificiales que se pueden producir en el laboratorio, la mayoría de los cuales tienen vidas medias de menos de un día.
El lantano se ha asociado con una leve toxicidad en ensayos con animales, en los que provoca un aumento del azúcar en sangre y un descenso de la presión sanguínea, además de afectar a la función del bazo y el hígado. Personas expuestas a compuestos de lantano emitidos por las luces de arco de carbono han desarrollado posteriormente neumoconiosisNeumoconiosisEs un conjunto de enfermedades pulmonares producidas por la inhalación de polvo y la consecuente deposición de residuos sólidos inorgánicos o —con menos frecuencia— partículas orgánicas en los bronquios, los ganglios linfáticos y o el parénquima pulmonar, con o sin disfunción respiratoria asociada. El tipo, cantidad, tamaño y plasticidad de las partículas inhaladas así como la duración de la exposición y la resistencia individual determinan el tipo de sintomatología, así como el curso de la enfermedad. El término neumoconiosis maligna se aplica a una marcada fibrosis progresiva del pulmón, que llevan a limitaciones funcionales severas. Algunos ejemplos son la silicosis, la asbestosis, talcos, antrosilicosis y otras fibras minerales. La neumoconiosis benigna suelen ser episodios inactivos de almacenamiento del irritante, o reacciones inflamatorias alérgicas, a veces con cambios fibróticos, por ejemplo, la neumoconiosis por aluminio (también llamada «aluminosis del pulmón»), beriliosis, bagazosis, bisinosis, neumoconiosis asociada a tuberculosis y el polvo de hierro en el pulmón. Wikipedia , una debilitado la enfermedad pulmonar.
NÚMERO ATÓMICO → 21
PESO ATÓMICO → 44,955912
PUNTO DE FUSIÓN → 1541 °C
COLOR → BLANCO PLATEADO
PUNTO DE EBULLICIÓN → 2836 °C
FASE → SÓLIDO
ESTRUCTURA CRISTALINA → HEXAGONAL

Observando el nombre de este elemento podemos descubrir cuál es su procedencia. Durante un análisis de muestras de minerales recogidos en Escandinavia fue donde apareció.
Su existencia no fue una sorpresa. Dmitri MendeléyevDmitri Ivánovich Mendeléyev Wikipedia, el químico ruso que originalmente formuló la tabla periódica en 1869, especuló que debía haber otro elemento que llenase una laguna en la tabla entre el calcio (número atómico 20) y el titanio (número atómico 22). The nominó a esta sustancia «eka-boro», nombre formado por el prefijo sánscrito eka, «uno, y «boro» (un elemento que Mendeléyev en un principio había clasificado en lo alto del grupo 3, y por tanto a sólo un lugar de la casilla que debía ocupar el eka-boro. 10 años más tarde Lars Fredrik NilssonLars Fredrik Nilson
Wikipedia, el químico ruso que originalmente formuló la tabla periódica en 1869, especuló que debía haber otro elemento que llenase una laguna en la tabla entre el calcio (número atómico 20) y el titanio (número atómico 22). The nominó a esta sustancia «eka-boro», nombre formado por el prefijo sánscrito eka, «uno, y «boro» (un elemento que Mendeléyev en un principio había clasificado en lo alto del grupo 3, y por tanto a sólo un lugar de la casilla que debía ocupar el eka-boro. 10 años más tarde Lars Fredrik NilssonLars Fredrik Nilson Wikipedia aisló por primera vez el escandio de una muestra del complejo mineral euxenita.
Wikipedia aisló por primera vez el escandio de una muestra del complejo mineral euxenita.
Sólo se pudieron conseguir cantidades minúsculas de un sólido blanco llamado escandia, u oxido de escandio. Nilson utilizó la espectrometríaEspectrometríaEs la técnica espectroscópica para tasar la concentración o la cantidad de especies determinadas. En estos casos, el instrumento que realiza tales medidas es un espectrómetro o espectrógrafo. Ecured para confirmar que había hallado un nuevo elemento. Esta técnica consistente en quemar una sustancia y hacer pasar la luz que desprende a través de un prisma para descomponerlas en sus colores constituyentes. Algunos de esos colores aparecen como bandas oscuras y el patrón de bandas es único para cada elemento. La muestra de Nilson absorbía la luz con una pauta que no se había visto nunca.
Pasó mucho tiempo hasta que en 1937, se consiguió producir un buen pedazo de metal escandio. Parte del problema era que el escandio se halla muy disperso por la corteza terrestre. A diferencia de otros elementos que se pueden obtener por minería, como el hierro y el oro, existen relativamente pocos depósitos concentrados de mena de escandio. Por consiguiente, fue necesario extraer y procesar una gran cantidad de material para producir una pequeña cantidad de este metal. La situación no ha cambiado demasiado y, por eso, la producción global de escandio no pasa de unas pocas decenas de kilogramos al año.
Pese a ello, el escandio encontrado algunos usos comerciales. Por ejemplo, basta añadir una diminuta cantidad (tan poco como 0,1 %) al aluminio para mejorar su dureza y otras propiedades mecánicas de la aleación resultante, hasta el punto de que las alegaciones de escandio-aluminio se han utilizado en la fabricación es de aviones, en particular del caza ruso MiG-29Mikoyan MiG-29M Wikipedia. También ha encontrado aplicaciones en equipamientos deportivos, como bates de béisbol y marcos de bicicleta. Por otro lado, las soluciones de escandio puro aceleran la germinación de semillas.
Wikipedia. También ha encontrado aplicaciones en equipamientos deportivos, como bates de béisbol y marcos de bicicleta. Por otro lado, las soluciones de escandio puro aceleran la germinación de semillas.
Otra aplicación del escandio es en lámparas de descargaLámpara de descargaLámparas de descarga son las lámparas eléctricas que utilizan como elemento luminoso corriente eléctrica a través de un gas, en contraposición a las lámparas de filamento que usan la circulación de corriente eléctrica en un sólido. El término descarga viene del hecho que se descarga corriente eléctrica a través del gas, ya que originalmente los altos voltajes necesarios para su funcionamiento provenían de la descarga de un capacitor. Cualquier gas es apto para la descarga eléctrica como lo demuestran los rayos que generan una gran cantidad de luz (relámpago) al circular corriente por el aire y vapor de agua en la nube. Wikipedia. Éstas funcionan cargando vapor con electricidad, que después se emite en forma de luz. Al añadir escandio a los vapores se obtiene una luz más suave, por tanto, apropiada para estudios y pabellones de deporte. Aunque el escandio es raro en la Tierra, es muy abundante en el espacio exterior, y se ha detectado en la luz del sol y de otras estrellas más lejanas.
NÚMERO ATÓMICO → 39
PESO ATÓMICO → 88,90585
PUNTO DE FUSIÓN → 1526 °C
COLOR → BLANCO PLATEADO
PUNTO DE EBULLICIÓN → 3336 °C
FASE → SÓLIDO
ESTRUCTURA CRISTALINA → HEXAGONAL

El itrio fue observado por primera vez en 1787 por un lugarteniente de infantería y químico aficionado llamado Carl Axel ArrheniusCarl Axel Arrhenius Wikipedia, cerca del pueblo de YtterbyYtterbyYtterby es un pueblo en la isla de Resarö, en el archipiélago de Estocolmo, en Suecia. Pertenece a la municipalidad de Vaxholm. El pueblo es famoso por la mina de Ytterby, donde se descubrieron algunas tierras raras. Entre ellas se encuentran los elementos químicos erbio, terbio, iterbio, e itrio, todos ellos nombrados en homenaje al pueblo, el gadolinio (nombrado en homenaje al profesor finlandés Johan Gadolin), el holmio (por el nombre latino de Estocolmo), y el tulio (de «Thule», nombre antiguo de Escandinavia). , en Suecia. Arrhenius encontró un fragmento de roca negra parecida al carbón en una cantera cercana al pueblo. Perplejo por su elevado peso, envió a la roca a unos colegas químicos para que la analizasen. Éstos descubrieron que aquella roca contenía un nuevo mineral (que pasaría a conocerse como «gadolinita», por el nombre de uno de los químicos). Análisis posteriores realizados en 1843 por el químico Carl Gustav Mosander revelaron que la gadolinita albergaba el oxido de un nuevo elemento, que recibió el nombre de «itrio». De hecho, no tardó en descubrirse que el mineral contenía también los óxidos de dos nuevos elementos más, el el el erbio y el terbio. 35 años más tarde se descubrió un cuarto elemento nuevo en la gadolinita, al que se bautizó como «iterbio».
Wikipedia, cerca del pueblo de YtterbyYtterbyYtterby es un pueblo en la isla de Resarö, en el archipiélago de Estocolmo, en Suecia. Pertenece a la municipalidad de Vaxholm. El pueblo es famoso por la mina de Ytterby, donde se descubrieron algunas tierras raras. Entre ellas se encuentran los elementos químicos erbio, terbio, iterbio, e itrio, todos ellos nombrados en homenaje al pueblo, el gadolinio (nombrado en homenaje al profesor finlandés Johan Gadolin), el holmio (por el nombre latino de Estocolmo), y el tulio (de «Thule», nombre antiguo de Escandinavia). , en Suecia. Arrhenius encontró un fragmento de roca negra parecida al carbón en una cantera cercana al pueblo. Perplejo por su elevado peso, envió a la roca a unos colegas químicos para que la analizasen. Éstos descubrieron que aquella roca contenía un nuevo mineral (que pasaría a conocerse como «gadolinita», por el nombre de uno de los químicos). Análisis posteriores realizados en 1843 por el químico Carl Gustav Mosander revelaron que la gadolinita albergaba el oxido de un nuevo elemento, que recibió el nombre de «itrio». De hecho, no tardó en descubrirse que el mineral contenía también los óxidos de dos nuevos elementos más, el el el erbio y el terbio. 35 años más tarde se descubrió un cuarto elemento nuevo en la gadolinita, al que se bautizó como «iterbio».
El itrio se califica a veces como una «tierra rara» porque en su forma y propiedades se parece mucho a la serie de tierras raras o lantánidos y suele encontrarse en los mismo yacimientos. No se da nunca en la naturaleza en su forma metálica puras. De hecho, el metal itrio no se purificó a partir de minerales hasta 1828, cuando el alemán Friedrich Wohler combinó cloruro de itrio con potasio para formar cloruro de potasio y el esquivo mineral blanco plateado.
Se conocen más de 30 isótopos de este elemento, todos radiactivos. Uno de ellos, Y-90, producto de la desintegración del estroncio, es muy eficaz en el tratamiento del cáncer. La química de este isótopo le permite unirse a anticuerpos que buscan y se unen a las células cancerosas, de forma que la radiación emitida por el itrio puede destruirla selectivamente.
El itrio se ha usado mucho en la producción de granates sintéticos. En particular, los granates de itrio y aluminio (YAG, por sus siglas en inglés, con fórmula Y3 Al2 (AlO4)3) forman cristales de muy alta calidad. Esto llevó a su utilización como imitación de diamante en joyería antes de que la circo ni tase revelarse como una alternativa mejor. Los YAG todavía se utilizan en láseres, en los que estos cristales se cargan de energía que luego emiten en forma de luz de láser. Los láseres de YAG son muy potentes, capaces de cortar metal, lo bastante fiables para usarse en cirugía y lo bastante brillantes para reflejarse en la luna y volver, en experimentos diseñados para establecer la distancia a nuestro satélite.
Pero la aplicación más importante del itrio es en el desarrollo de superconductores. La mayoría de los conductores eléctricos manifiestan una «resistencia» que impide el flujo de la corriente eléctrica. Los superconductores tienen resistencia cero, lo que significa que la corriente eléctrica podría circular en un bucle indefinidamente. El problema es que los conductores tienen que enfriarse hasta -273 °C con la ayuda de aparatosos sistemas de refrigeración. Sin embargo, en 1987 se descubrió que un compuesto, el oxido de itrio, bario y cobre (YBCO), se convierte en superconductor a -180 °C, que, aunque frío, es lo bastante cálido para que se pueda usar nitrógeno líquido como refrigerante en lugar de helio líquido, más frío pero más caro.
NÚMERO ATÓMICO → 58
PESO ATÓMICO → 140,116
PUNTO DE FUSIÓN →
COLOR → GRIS HIERRO
PUNTO DE EBULLICIÓN → 3443 °C
FASE → SÓLIDO
ESTRUCTURA CRISTALINA → CÚBICA CENTRADA EN LAS CARAS

El cerio es el segundo elemento de la secuencia de lantánidos. Los químicos suecos Jöns Jacob VerceliusJöns Jacob Berzelius Wikipedia y Wilhelm HisingerWilhelm Hisinger
Wikipedia y Wilhelm HisingerWilhelm Hisinger Wikipedia lo descubrieron en 1803, y lo llamaron así en honor al asteroide Ceres (técnicamente, un planeta en la clasificación actual), que se había descubierto tan sólo dos años antes.
Wikipedia lo descubrieron en 1803, y lo llamaron así en honor al asteroide Ceres (técnicamente, un planeta en la clasificación actual), que se había descubierto tan sólo dos años antes.
A causa de su similitud, la mayoría de los elementos lantánidos se descubrieron dentro de las mismas menas minerales. No así el cerio, que se descubrió en las llamadas sales de cerio, unos minerales compuesto casi enteramente por este elemento. Uno de ellos, el silicato de cerio (cerita) se consideró en un principio una mena de tungsteno, cuando se descubrió este metal a mediados del siglo XVIII. Sin embargo, los análisis de Berzelius y Hisinger revelar más tarde que se trataba de la mena de un nuevo elemento. El cerio en su forma metálica pura no se pudo obtener hasta 1875, usando técnicas electroquímicas.
El cerio es el más abundante de todos los lantánidos. Con una concentración en la corteza terrestre de 46 ppm (en masa), es casi tan común como el cobre. El elemento se extrae de las mismas menas que otros lantánidos, como la bastnasita y la monacita, mediante un proceso de fragmentación, calentamiento y tratamiento con ácido.
El cerio es en cierto modo un elemento verde, no por el color, sino porque ofrece un abanico de aplicaciones beneficiosas para el medio ambiente. El sulfuro de cerio tiene un intenso color rojo que lo hacen excelente como pigmento en sustitución de otras sustancias más tóxicas, como el cadmio, el mercurio y el plomo. El oxido de cerio se usa en la fabricación de convertidores catalíticos, y en los escapes de motores de coche forma parte del catalizador que almacena y libera el oxígeno necesario para convertir el monóxido de carbono en dióxido de carbono. Por otro lado, en los motores diésel, la adición de una pequeña cantidad de cerio al gasóleo reduce notablemente la cantidad de partículas sólidas contaminantes liberadas a la atmósfera gracias a que favorece su combustión en el motor.
El cerio tiene muchas otras aplicaciones. Se usa en el revestimiento de las paredes de los hornos catalíticos, que se limpian solos gracias a que ayudan a oxidar los residuos de la cocción, convirtiéndolos en cenizas fáciles de quitar con una bayeta. También se usa en los tubos de rayos catódicos de los antiguos televisores para reducir el oscurecimiento de la pantalla a causa del continuo bombardeo de electrones de alta energía, y una forma de oxido de cerio se utilizó para producir las primeras camisas para lámparas de gas. Deslizar un cuchillo por un trozo de cerio produce una impresionante lluvia de chispas que puede usarse para encender fuego (es «pirofórico»Pirofórico, caDel gr. πυροφορικός pyrophorikós «ignífero». → 1. adj. Fís. Que se inflama espontáneamente en contacto con el aire.), lo que ha conducido aplicaciones en piedras de mecheros y barras de encendido de hogueras. Administrado oralmente en dosis bajas, el cerio tiene incluso propiedades medicinales como fármaco contra las náuseas.
Hay cuatro isótopos estables de cerio, con masas atómicas 136, 138, 140 y 142. De estos, Ce-140 constituye el 88,5% de los depósitos naturales. Hay 26 isótopos radiactivos. El cerio presenta una toxicidad moderada y, en los humanos, provoca irritación de la piel.
NÚMERO ATÓMICO → 59
PESO ATÓMICO → 140,90765
PUNTO DE FUSIÓN → 935 °C
COLOR → GRIS PLATEADO
PUNTO DE EBULLICIÓN → 3520 °C
FASE → SÓLIDO
ESTRUCTURA CRISTALINA → HEXAGONAL

Este metal de nombre un tanto ampuloso fue descubierto como parte de otro elemento que ni siquiera resulto serlo. En 1841, el químico sueco Carl Gustav Mosander extrajo el elemento lantano de un compuesto de cerio. Pero ahí no acabó todo. Mosander creía que el residuo que había quedado correspondía otro elemento, al que llamó «didimio». En 1832, los análisis espectrales suscitaron la sospecha de que el didimio no era un elemento puro. Pocos años después, 1885, el químico austríaco Carl Auer von WelsbachCarl Auer von Welsbach Wikipedia confirmó esa sospecha al conseguir separar el didimio en dos elementos nuevos: neodimio y praseodimio.
Wikipedia confirmó esa sospecha al conseguir separar el didimio en dos elementos nuevos: neodimio y praseodimio.
El nombre praseodimio viene del griego y significa «gemelos verdes»; lo de verde porque cuando el elemento se oxida por una capa exterior de color verde que se descascarilla con facilidad. El praseodimio tiene número atómico 59, lo que lo sitúan la secuencia de elementos lantánidos (también conocidos como «tierras raras»), que se colocan en una tira horizontal al pie de la tabla periódica. Físicamente, es un metal gris plateado y a un tiempo maleable y dúctil (lo que significa que es fácil de aplanar en láminas y destilar en alambre, respectivamente).
Pese a ser una «tierra rara», el praseodimio es bastante común, con una concentración en la corteza terrestre de 9,5 ppm, unas cuatro veces más común que el estaño. Sólo tiene un hisopo natural, Pr-141. Este isótopo es estable, pero en las reacciones nucleares se producen muchos otros isótopos radiactivos, con números de masa entre 121 y 159. Es más estable de estos, el Pr-143, tiene una vida de media de 13,5 días, mientras que la mayoría quedan por debajo de 10 minutos.
La producción global anual de óxido de praseodimio es de 2500 toneladas, de las que sólo una pequeña fracción se convierte metal puro. El elemento se extrae de los minerales monacita y bastnasita, donde constituye alrededor del 5 % de lo lantánidos que se encuentran en estas menas.
Una de las aplicaciones más importantes del praseodimio es en componentes de alta durabilidad para motores de aviación, donde el elemento se utiliza en aleaciones con magnesio para formar un material de construcción superfuerte. Otra de sus aplicaciones importante es en las máscaras de soldadura. En este caso, una pequeña cantidad de praseodimio añadida al vidrio filtra la radiación calorífica de infrarrojos y bloquea de forma eficiente la luz amarilla brillante de las llamas, que de otro modo no sólo leería a desviar la mirada. Otros de sus usos se encuentran en los núcleos de las luces de arco de carbono de la industria cinematográfica y para colorear de verde las piedras cúbicas decir con mitad de modo que se parezcan al peridotoPeridoto El peridoto es un olivino con calidad de gema; tiene una gran cantidad de magnesio en su estructura y posee un brillo vítreo. Su composición química es (Mg, Fe)2 SiO4. Es una de las gemas «idiocromáticas», es decir que su color viene de la composición química básica del mismo mineral, no de impurezas menores, y por lo tanto se encuentra solo en tonos verdes. El peridoto es una de las pocas piedras preciosas encontradas en un solo color. Son comúnmente confundidos con las esmeraldas pese a poseer un tono más amarillento. Wikipedia.
El peridoto es un olivino con calidad de gema; tiene una gran cantidad de magnesio en su estructura y posee un brillo vítreo. Su composición química es (Mg, Fe)2 SiO4. Es una de las gemas «idiocromáticas», es decir que su color viene de la composición química básica del mismo mineral, no de impurezas menores, y por lo tanto se encuentra solo en tonos verdes. El peridoto es una de las pocas piedras preciosas encontradas en un solo color. Son comúnmente confundidos con las esmeraldas pese a poseer un tono más amarillento. Wikipedia.
El praseodimio se ha utilizado incluso para conseguir la temperatura más baja de la Tierra, ya que se trata de un material magnetocalóricoRefrigeración magnéticaLa refrigeración magnética es una tecnología de enfriamiento basada en el efecto magnetocalórico. Esta técnica puede usarse para lograr temperaturas extremadamente bajas, así como rangos de temperaturas como los usados en los refrigeradores normales. Comparado con la refrigeración de gas tradicional, la refrigeración magnética es más segura, silenciosa, compacta, tiene una mayor eficiencia y es más respetuosa con el medio ambiente al no usar gases perjudiciales para la capa de ozono. Wikipedia, lo que significa que se puede bajar su temperatura con un campo magnético. Esta propiedad ha permitido a los científicos enfriarlo hasta una milésima de grado centígrado del cero absoluto: -273,15 °C. Por otro lado, en la investigación fundamental, el praseodimio se ha añadido al vidrio para reducir la velocidad de la luz de su interior de 300 000 km/s a solo unos pocos cientos.
NÚMERO ATÓMICO → 60
PESO ATÓMICO → 140,242
PUNTO DE FUSIÓN → 1024 °C
COLOR → BLANCO PALTEADO
PUNTO DE EBULLICIÓN → 3074 °C
FASE → SÓLIDO
ESTRUCTURA CRISTALINA → HEXAGONAL

El neodimio fue uno de los dos elementos químicos extraídos de una sustancia conocida como «didimio». Cuando se descubrió en la década de 1840, se creyó que el didimio era un elemento, pero varios estudios enseguida alertaron a los químicos de que no se trataba de una sustancia fundamental. Así lo confirmó en 1885 el químico austríaco Carl Auer von Welsbach, que logró aislar en el didimio dos nuevos elementos (esta vez genuinos), que recibieron los nombres de «praseodimio» y «neodimio».
El nombre neodimio significa «nuevo gemelo» en griego. Este elemento forma parte de la serie de lantánidos, una franja de elementos que se suelen presentar al pie de la tabla periódica por conveniencia. Es el segundo lantánido más abundante y casi tan común como el cobre (a pesar del nombre alternativo que históricamente recibían los lantánidos, hoy casi obsoleto: «tierras raras»). Como los otros lantánidos, se extrae sobre todo de los minerales bastnasita y monacita, de los que constituyen entre un 10 y un 18 %. Estos minerales extraen en Australia, China, Brasil, India, Sri Lanka y Estados Unidos.
El elemento tiene cinco isótopos estables, con masas atómicas 142, 143, 145, 146 y 148. También hay dos radioisótopos naturales, en Nd -144 y Nd-150, con vidas medias de 2290 billones de años y 7 trillones de años, aproximadamente 150 000 veces y 500 millones de veces la edad actual del universo.
El neodimio es importante para la fabricación de imanes de gran potencia. En 1983 se descubrió que una aleación de neodimio, hierro y boro (conocida como NIB) posee propiedades magnéticas muy superiores a las de cualquier otro imán permanente conocido. Tanto es así que los imanes NIB se utilizan en multitud de aplicaciones que requieren fuentes magnéticas pequeñas pero potentes, por ejemplo en auriculares intraauditivos, discos duros de ordenador e incluso en motores de aeromodelismo, en los que los motores con imanes de neodimio están reemplazando a los motores de combustión interna. El uso de neodimio en los imanes que impulsan los motores eléctricos ha llevado a su uso en coches híbridos, donde lo que se persigue es un motor eléctrico que compita con los que funcionan con gasolina. Cada uno de los motores eléctricos que mueven los coches híbridos Toyota Prius™ requieren 1 kg de neodimio en sus imanes.
Se conoce un caso en el que dos imanes NIB separados medio metro se juntaron con tanta fuerza que cortaron la punta de un dedo que se interpuso en su camino. Si se ingieren, la fuerza que atrae a dos de estos imanes desde dos secciones distintas del tubo gástrico pueden provocar lesiones graves.
Además de por sus propiedades magnéticas, el neodimio se usa también como aditivo en el vidrio (para darle una atractiva tonalidad azulada o púrpura), para colorear la luz de las bombillas y en las construcciones de vidrio para que bloquee radiaciones dañinas (como la infrarroja o radiación de «calor»). Por otro lado, el neodimio se utiliza también en láseres; los llamados láseres Nd-YAG usan una aleación de granate de itrio-aluminio y neodimio para generar un intenso haz de luz coherente, que a su vez tiene multitud de aplicaciones en la industria y la tecnología de consumo.
NÚMERO ATÓMICO → 61
PESO ATÓMICO → 145
PUNTO DE FUSIÓN → 1042 °C
COLOR → PLATEADO
PUNTO DE EBULLICIÓN → 3000 °C
FASE → SÓLIDO
ESTRUCTURA CRISTALINA → HEXAGONAL

El prometio es una excepción a los otros elementos de la tabla de los lantánidos. El prometio prácticamente no existe en la Tierra en estado natural, por la sencilla razón de que es muy radiactivo. La mayoría de los elementos con número atómico inferior a 83 (bismuto) son estables, o no radiactivos. Las dos únicas excepciones son el tecnecio y el prometio. Esto se debe a una peculiaridad en el modo en que protones y neutrones se disponen en su núcleo, que impide que las partículas encuentren acomodo en una configuración estable.
El isótopo radiactivo más estable del prometio, Pm-145, tienen una vida media de 17,7 años; sin embargo, para la mayoría de los isótopos esta cifra es inferior a 10 minutos, lo que significa que la desintegración radiactiva hace que la cantidad de Pm-145 de una muestra se reduzca a la mitad cada 17,7 años; así pues, 1 millón de toneladas de isótopo más estable del prometio se reduce a 1 g en poco menos de 700 años.
La tierra tiene una edad estimada de 4500 millones de años, de modo que el prometio que tuviera en su origen, hace ya mucho tiempo que se ha desintegrado.
En 1914, el físico británico Henry MoseleyHenry Gwyn Jeffreys Moseley  Wikipedia se percató de que había una laguna en la tabla periódica entre el neodimio (número atómico 60) y el samario (número atómico 62). En la década de 1920, dos grupos de investigadores afirmaron haber encontrado el elemento 61 que faltaba. En 1926, un equipo de Florencia (Italia) declaró haberlo aislado a partir del mineral monacita. Aquel mismo año, científicos de la Universidad de Illinois hicieron una declaración parecida. Los elementos propuestos recibieron incluso nombres: «florencio» e «illinio».
Wikipedia se percató de que había una laguna en la tabla periódica entre el neodimio (número atómico 60) y el samario (número atómico 62). En la década de 1920, dos grupos de investigadores afirmaron haber encontrado el elemento 61 que faltaba. En 1926, un equipo de Florencia (Italia) declaró haberlo aislado a partir del mineral monacita. Aquel mismo año, científicos de la Universidad de Illinois hicieron una declaración parecida. Los elementos propuestos recibieron incluso nombres: «florencio» e «illinio».
Sin embargo, el elemento 61 no fue realmente descubierto hasta 1945, cuando científicos de Oak Ridge National Laboratory en Tennessee (EE. UU.) examinaron el residuo de uno de los primeros reactores nucleares de fisión; el prometio es uno de los productos de la desintegración del uranio. Una cantidad sustancial de metal puro no se obtuvo hasta 1963 cuando se sintetizaron 10 gramos del elemento.
El equipo autor de su descubrimiento incluía a Charles CoryellCharles DuBois Coryell  Wikipedia. Fue a su esposa a quien se le ocurre lo nombre «prometio» por Prometeo, el titán del mito griego que le robó el fuego a los dioses del Olimpo y se lo ofreció a la humanidad.
Wikipedia. Fue a su esposa a quien se le ocurre lo nombre «prometio» por Prometeo, el titán del mito griego que le robó el fuego a los dioses del Olimpo y se lo ofreció a la humanidad.
El prometio se utilizó durante algún tiempo en las esferas luminosas de los relojes, aunque su corta vida media hacía que el efecto no durase mucho. Encontró otros usos en baterías, por ejemplo, en vehículos espaciales, y como emisores de radiación predecibles.
NÚMERO ATÓMICO → 62
PESO ATÓMICO → 150,36
PUNTO DE FUSIÓN → 1972 °C
COLOR → BALNCO PLATEADO
PUNTO DE EBULLICIÓN → 1794 °C
FASE → SÓLIDO
ESTRUCTURA CRISTALINA → ROMBOÉDRICA

El samario suele considerarse el primer elemento que ha recibido su nombre en honor a una persona, aunque de manera indirecta. En realidad, recibió su nombre del mineral samarskita, pero este a su vez lo había recibido en honor al ingeniero ruso Vasili Samarsky-Bykhovets.
Samarsky-BykhovetsVasili Yevgrafovich Samarsky-Bykhovets El propio Samarsky-Bykhovets no participó en los estudios sobre la samarsquita y el samario. Como funcionario de minas, se limitó a conceder acceso a muestras de minerales de los Urales al mineralogista alemán Gustav Rose y a su hermano Heinrich Rose. En 1839, Gustav Rose describió un nuevo mineral en esas muestras y lo denominó uranotantalio por considerar que en su composición predominaba el elemento químico tantalio. En 1846-47, su hermano y colega, el mineralogista Heinrich Rose, descubrió que el componente principal del mineral era el niobio y sugirió modificar el nombre para evitar confusiones. El nuevo nombre elegido, samarskita, reconocía el papel de Samarsky-Bijovets en el acceso a las muestras del mineral. Más tarde, se aislaron varios elementos lantánidos de este mineral, y uno de ellos, el samario, recibió el nombre del mineral, honrando una vez más a Samarsky-Bijovets. Wikipedia no participó en su descubrimiento, pero como director del Cuerpo Ruso de Ingeniería de Minas, fue él quien permitió al mineralogista alemán Gustav RoseGustav Rose Wikipedia la obtención de muestras minerales. En 1839, Rose descubrió un nuevo mineral, y como muestra de gratitud le dio su nombre. En 1879, el químico francés Paul Émile Lecoq de BoisbaudranPaul Émile (François) Lecoq de Boisbaudran
Wikipedia la obtención de muestras minerales. En 1839, Rose descubrió un nuevo mineral, y como muestra de gratitud le dio su nombre. En 1879, el químico francés Paul Émile Lecoq de BoisbaudranPaul Émile (François) Lecoq de Boisbaudran Wikipedia logró extraer de la samarskitaSamarskita
Wikipedia logró extraer de la samarskitaSamarskita Wikipedia el mineral didimio, que se consideró un elemento durante algún tiempo, aunque más tarde se probó que era una mezcla de praseodimio y neodimio. Aquel mismo año, Boisbaudran consiguió extraer otra sustancia química de la samarskita, que tras meticulosos ensayos se pudo demostrar que se trataba de un verdadero elemento nuevo. Recibió el nombre de «samario».
Wikipedia el mineral didimio, que se consideró un elemento durante algún tiempo, aunque más tarde se probó que era una mezcla de praseodimio y neodimio. Aquel mismo año, Boisbaudran consiguió extraer otra sustancia química de la samarskita, que tras meticulosos ensayos se pudo demostrar que se trataba de un verdadero elemento nuevo. Recibió el nombre de «samario».
El samario es uno de los miembros del grupo de los lantánidos, una secuencia de quince elementos que ocupa una franja al pie de la tabla periódica; se oxida en el aire húmedo, formando una costra en el exterior, y se inflama a una temperatura de 150 °C.
Pese a su descubrimiento inicial en la samarskita, la fuente más rica en este elemento es el mineral monacita, donde el samano comprende un 3 % de la masa del mineral. Hay minas en Australia, Sri Lanka y China.
El samario se utilizó en un principio en imanes, los más potentes jamás desarrollados, hasta que comenzó la producción de imanes con aleaciones de neodimio. Aun así, los imanes de samario-cobalto siguen siendo 10 000 veces más potentes que los de hierro. A diferencia de las aleaciones de neodimio, los imanes de samario no pierden su magnetismo a altas temperaturas, sino que lo mantienen por encima de 700 °C. Los imanes de samario-cobalto se utilizan todavía en las pastillas de las guitarras eléctricas.
El samario tiene propiedades eléctricas inusuales. El compuesto sulfuro de samario se presenta en forma de cristales negros con propiedades semiconductoras, entre un material conductor y uno aislante. Pero bajo una presión de 20-30 atmósferas, se convierte en un sólido metálico de lustro dorado que conduce la electricidad con facilidad.
Hay siete isótopos naturales de samario, tres de ellos radiactivos, Sm-147, 148 y 149, todos con vidas medias de cientos de miles de millones de años. Pero también hay isótopos sintetizados artificialmente; de estos, Sm-153 probablemente sea el más importante, pues su radiación lo convierte en un eficaz destructor de células cancerosas.
El samario ha demostrado ser útil no solo por su emisión de radiación sino también por su capacidad para absorberla. Sm-149 absorbe fácilmente neutrones, las partículas que desencadenan las reacciones de fisión nuclear. Por esta razón, se utiliza como moderador en las barras de control que regulan la tasa de producción de energía en el interior de un reactor nuclear.
NÚMERO ATÓMICO → 63
PESO ATÓMICO → 151,964
PUNTO DE FUSIÓN → 826 °C
COLOR → BLANCO PLATEADO
PUNTO DE EBULLICIÓN → 1539
FASE → SÓLIDO
ESTRUCTURA CRISTALINA → CÚBICA CENTRADA EN EL CUERPO

Quienes disfrutamos de la televisión en color antes de la llegada de las pantallas planas debemos estar agradecidos con el europio, un elemento esencial en el desarrollo de fósforos rojos eficaces, utilizado para revestir el intenor do los tubos de rayos catódicos de las pantallas Cada punto de estas pantallas es un conjunto de puntos de fósforo rojo, verde y azul que. al ser bombardeados con electrones, emiten luz, un fenómeno conocido como «fluorescencia». El color en cada punto se ajusta con la ayuda de un campo eléctrico que dirige el haz hacia el fósforo o la combinación de fósforos que produce el color correcto.
Fabricar los fósforos luminiscentes de los colores verde y azul era fácil; se usaba para ello sulfuro do cinc con la adición de cobre o plata, respectivamente. Pero al principio los fósforos rojos eran tan pobres que era necesario reducir el brillo de los otros colores para mantener un balance de colores adecuado. Todo eso cambió con el descubrimiento de los fósforos basados en europio, que emiten copiosamente en la porción roja del espectro de la luz visible. El pequeño número de tubos de rayos catódicos que aun se produce en la actualidad usan fósforos rojos hechos con sulfuro-óxido de itrio dopado con una pequeña cantidad de europio.
La capacidad del elemento para emitir luz roja ha llevado a que también se utilice en bombillas fluorescentes de bajo consumo, en las que la adición de un poco de color rojo suaviza la dura luz blanca típica de ios tubos fluorescentes. El europio tiene aplicaciones también en láseres, así como en superconductores, materiales en los que la resistencia eléctrica desaparece del todo. El europio es uno de los lantánidos, o «tierras raras», que aparecen al pie de la tabla periódica Fue descubierto en 1901 por el químico francés Eugène-Anatole DemarcayEugène-Anatole Demarçay Wikipedia, quien dedujo que unas muestras del recién descubierto elemento samario estaban contaminadas con una pequeña cantidad de otro elemento. Por medio de una compleja secuencia de reacciones químicas, logró aislar lo que habría de conocerse como «europio» en honor al continente de Europa.
Wikipedia, quien dedujo que unas muestras del recién descubierto elemento samario estaban contaminadas con una pequeña cantidad de otro elemento. Por medio de una compleja secuencia de reacciones químicas, logró aislar lo que habría de conocerse como «europio» en honor al continente de Europa.
El europio es un metal suave de color plateado. Arde a 180 °C se oxida rápidamente en contacto con el aire y reacciona fácilmente con el agua. Es uno de los lantánidos menos abundantes; anualmente se obtienen en todo el mundo apenas cien toneladas del metal puro, a partir de minerales extraídos en minas de China y EE.UU. Las fuentes de europio incluyen las rocas bastnasita y monacita, así como la loparita, un mineral gris oscuro, y la xenotima, de color pardo amarillo.
El europio se encuentra en la naturaleza en dos isótopos estables con masas atómicas de 151 y 153. Es, en cierto modo, una rareza en el sentido de que su concentración en minerales, con relación a los otros lantánidos, suele ser anormalmente alta o baja. Esta «anomalía del europio» se ha hecho evidente en muestras de rocas traídas desde la Luna.
La rocas recogidas de las «mesetas» lunares blancas muestran una marcada anomalia positiva (exceso de europio), mientras que las recogidas en los «mares», más oscuros, presentan una anomalia fuertemente negativa. Algunos estudiosos han interpretado esto como prueba de que la Tierra y la Luna no se formaron a partir del mismo material original.
NÚMERO ATÓMICO → 64
PESO ATÓMICO → 150,25
PUNTO DE FUSIÓN → 1312 °C
COLOR → PLATEADO
PUNTO DE EBULLICIÓN → 3273 °C
FASE → SÓLIDO
ESTRUCTURA CRISTALINA → HEXAGONAL

El gadolinio es uno de los elementos más comunes de la serie de los lantánidos. Fue descubierto en 1880 por el químico suizo Jean Charles Galissard de MarignacJean Charles Galissard de Marignac Wikipedia, que encontró un nuevo óxido escondido en el mineral didimio. Este mineral se había tenido en otros tiempos por un elemento puro, pero más tarde se demostró que era una mezcla formada fundamentalmente por dos elementos (que habrían de llamarse «praseodimio» y «neodimio»). En 1880, Marignac logró aislar el óxido de otro elemento nuevo y genuino a partir del didimio. En 1886, el químico francés Paul Émile Lecoq de Boisbaudran consiguió extraer el elemento puro del óxido. Fue Boisbaudran quien sugirió el nombre «gadolinio», por el mineral gadolinita, que es una fuente en la que abunda este elemento, y Marignac aceptó. La gadolinita fue descubierta cerca del pueblo sueco de Ytterby en 1780, y la llamaron así en honor al químico finés Johan Gadolin, que fue el primero en describirlo.
Wikipedia, que encontró un nuevo óxido escondido en el mineral didimio. Este mineral se había tenido en otros tiempos por un elemento puro, pero más tarde se demostró que era una mezcla formada fundamentalmente por dos elementos (que habrían de llamarse «praseodimio» y «neodimio»). En 1880, Marignac logró aislar el óxido de otro elemento nuevo y genuino a partir del didimio. En 1886, el químico francés Paul Émile Lecoq de Boisbaudran consiguió extraer el elemento puro del óxido. Fue Boisbaudran quien sugirió el nombre «gadolinio», por el mineral gadolinita, que es una fuente en la que abunda este elemento, y Marignac aceptó. La gadolinita fue descubierta cerca del pueblo sueco de Ytterby en 1780, y la llamaron así en honor al químico finés Johan Gadolin, que fue el primero en describirlo.
Cada año se extraen aproximadamente 400 toneladas de gadolinio metal de unas reservas totales estimadas en un millón de toneladas. Se obtiene en minas de Australia, China, Brasil y Sri Lanka, por nombrar unas pocas.
El elemento puro y su óxido se suelen extraer de los minerales bastnasita y monacita por medio de un complejo procedimiento químico. El gadolinio tiene seis isótopos estables naturales (con números atómicos 154, 158 y 160) y uno radiactivo (Gd-152, que tiene una vida media de 108 billones de años, muchos miles de veces la edad del universo). Hay también una larga lista de isótopos radiactivos de gadolinio sintetizados, con vidas medias que van de millones de años a apenas unas decenas de segundos.
El gadolinio es el mejor absorbente de neutrones entre los elementos estables. Solo hay un isótopo elemental que lo supere: el Xenón-135, que es inestable. Por esta razón, el gadolinio se utiliza como absorbente de neutrones en reactores de fisión nuclear (en los que los neutrones son las partículas responsables de perpetuar las reacciones en cadena) y en las técnicas de imagen médica, en las que una pantalla de gadolinio bombardeada con neutrones emite brevemente una radiación penetrante que se puede usar para crear imágenes intemas de los pacientes.
El gadolinio es ferromagnético (lo que significa que es atraído por un imán), pero solo si su temperatura está por debajo de 19 °C; por encima, estas propiedades desaparecen rápidamente. El punto en el que esto ocurre se conoce como temperatura de Curie (por Pierre CuriePierre Curie Wikipedia, el marido de Marie). Para que un material sea ferromagnético, tienen que estar alineados los ejes de espín magnético de todos sus electrones. Sin embargo, en el gadolinio el movimiento térmico de los átomos perturba este alineamiento, lo que puede tener aplicaciones en sistemas de refrigeración controlados magnéticamente.
Wikipedia, el marido de Marie). Para que un material sea ferromagnético, tienen que estar alineados los ejes de espín magnético de todos sus electrones. Sin embargo, en el gadolinio el movimiento térmico de los átomos perturba este alineamiento, lo que puede tener aplicaciones en sistemas de refrigeración controlados magnéticamente.
El gadolinio también responde a los campos magnéticos generados en el interior de un escáner de resonancia magnética. Cuando se inyecta en un paciente un compuesto de gadolinio formulado para que sea absorbido por cierta parte del cuerpo, esa parte quedará resaltada en la imagen del escáner.
NÚMERO ATÓMICO → 65
PESO ATÓMICO → 158,92535
PUNTO DE FUSIÓN → 1356 °C
COLOR → BLANCO PLATEADO
PUNTO DE EBULLICIÓN → 3230 °C
FASE → SÓLIDO
ESTRUCTURA CRISTALINA → HEXAGONAL

Son varios los elementos químicos que se han descubierto en los ricos depósitos minerales cercanos al pueblo de Ytterby, en la región este central de Suecia. El terbio es uno de ellos y, al igual que el erbio, el itrio y el iterbio, recibe su nombre de la localidad.
El terbio fue descubierto por el químico sueco Carl Gustav Mosander, que trabajaba en Estocolmo. Mosander estaba estudiando muestras de «itria» (u óxido de itrio, por usar su nombre químico) recogidas en una cantera de Ytterby. Sus investigaciones lo llevaron a sospechar que aquellas muestras albergaban pequeñas cantidades de otro elemento todavía desconocido. En 1843, Mosander demostró que así era al lograr extraer óxido de terbio, o «terbia», de la itria. El terbio puro es de color blanco plateado.
Es maleable (fácil de comprimir), dúctil (fácil de estirar) y lo bastante blando para cortarlo con un cuchillo. Forma parte de la secuencia de lantánidos, un conjunto de 15 elementos con números atómicos entre 57 (lantano) y 71 (lutecio).
El terbio es bastante reactivo y, por consiguiente, no se encuentra en la naturaleza en su estado metálico puro, sino en forma en compuestos, especialmente óxido de terbio, confinados en minerales como la euxenita (1 % de terbio), monacita (0,03 % de terbio) y bastnasita (0,02 % de terbio). Otra fuente en encuentra en unas arcillas del sur de China que contienen un 1 % de terbio. A partir de estas materias primas, extraídas de minas de EE.UU., Sri Lanka, Australia, India, Brasil y China, cada año se producen unas diez toneladas del metal puro. El terbio es un bien de consumo caro, con un precio unas cuatro veces superior al del platino.
El terbio, o más bien una aleación de este elemento conocida como Terfenol-D, se expande y contrae cuando se le aplica un campo magnético, un curiosa propiedad que se conoce como «magnetostricción»MagnetostricciónSe denomina magnetostricción a la propiedad de los materiales magnéticos que hace que estos cambien de forma al encontrarse en presencia de un campo magnético. Las vibraciones en forma de sonido son causadas por la frecuencia de las fluctuaciones del campo. Este fenómeno es parte de la causa de que se encuentren vibraciones de 100 Hz o 120 Hz en máquinas eléctricas como motores y transformadores. Es una propiedad de los materiales ferromagnéticos de cambiar de forma en presencia de campos magnéticos. Para generar electricidad se utiliza la magnetrostricción inversa, la aplicación de compresión cambia el flujo magnético lo que según la ley de Faraday induce un campo eléctrico. El efecto fue identificado por el científico James Prescott Joule en 1842 cuando observaba níquel puro. Wikipedia. Esto significa que si se envuelve una bobina electromagnética alrededor de un trozo de Terfenol y se hace circular por ella una corriente eléctrica que varíe en el tiempo (del tipo que se usa, por ejemplo, para codificar una señal de audio), el Terfenol vibrará al son de la corriente. Si entonces se coloca el Terfenol sobre una superficie sólida, el sobre de una mesa, por ejemplo, las vibraciones se transmiten a la superficie, que se convierte en un enorme altavoz.
Este efecto ya se ha aprovechado comercialmente para desarrollar un dispositivo conocido como Soundbug™, que se puede adherir a cualquier superficie resonante, como el cristal de una ventana, y convertirla en una altavoz para el sistema de audio de la casa. El Terfenol-D también se usa en el sonar naval y cabe esperar que desempeñe un papel en el desarrollo de motores y actuadores de futuros robots.
El terbio se utiliza asimismo en la fabricación de fósforos verdes para tubos de rayos catódicos de televisores y luces fluorescentes, así como en dispositivos electrónicos de estado sólido y láseres. También tiene aplicaciones en las máquinas de rayos X usadas en medicina, donde se usa para mejorar la sensibilidad de los fósforos de la pantalla de la imagen. Esto ha permitido reducir por un factor de cuatro la dosis de rayos X a la que se somete a los pacientes.
NÚMERO ATÓMICO → 66
PESO ATÓMICO → 162,5
PUNTO DE FUSIÓN → 1407 °C
COLOR → BLANCO PLATEADO
PUNTO DE EBULLICIÓN → 2562 °C
FASE → SÓLIDO
ESTRUCTURA CRISTALINA → HEXAGONAL

El elemento químico disprosio fue descubierto en 1886 por el químico francés Paul Émile Lecoq de Boisbaudran, quien halló que unas muestras del elemento erbio parecían estar contaminadas con elementos desconocidos. Estos fueron aislados más tarde e identificados como holmio y turbio en experimentos realizados por Boisbaudran durante la década de 1870. Pero no se paró ahí, sino que enseguida se dio cuenta de que el óxido de holmio albergaba otro elemento desconocido. Boisbaudran necesitó una larguísima secuencia de pasos químicos para obtener una muestra de este elemento. Para marcar la consecución de tan hercúlea tarea, Boisbaudran llamó a su nuevo elemento químico «disprosio», por la palabra griega disprositos, que significa «difícil de alcanzar».
Y eso solo para purificar el óxido; la obtención de muestras puras del metal no sería posible hasta la década de 1950, cuando el químico canadiense Frank SpeddingFrank Harold Spedding Wikipedia, de la Universidad Estatal de Iowa, perfeccionó una técnica conocida como «cromatografía por intercambio de iones». El disprosio puro es un metal muy reactivo que no existe en la naturaleza. Es lo bastante blando para cortarlo con un cuchillo, se corroe con rapidez en el aire, se disuelve en ácido y produce hidrógeno en contacto con el agua, lo que quiere decir que no se debe intentar apagar con agua disprosio inflamado, o se producirá una explosión. Hay siete isótopos naturales del disprosio, con números atómicos 156,158 y 160-164; ninguno de ellos es radiactivo.
Wikipedia, de la Universidad Estatal de Iowa, perfeccionó una técnica conocida como «cromatografía por intercambio de iones». El disprosio puro es un metal muy reactivo que no existe en la naturaleza. Es lo bastante blando para cortarlo con un cuchillo, se corroe con rapidez en el aire, se disuelve en ácido y produce hidrógeno en contacto con el agua, lo que quiere decir que no se debe intentar apagar con agua disprosio inflamado, o se producirá una explosión. Hay siete isótopos naturales del disprosio, con números atómicos 156,158 y 160-164; ninguno de ellos es radiactivo.
El disprosio forma parte de la secuencia de lantánidos. Cada año se producen unas cien toneladas de disprosio a partir de los minerales monacita, xenotima, gadolinita y euxenita.
No se tiene una estimación definitiva de las reservas globales de este elemento, pero se predice una escasez; el precio aumentó de 15 dólares/kg (12,27 €) en 2003 a más de 280 dólares/kg (266,29 €) a finales de 2010. La razón de ello es que el disprosio es un constituyente menor de la aleación de neodimio-hierro-boro que se utiliza en la construcción de imanes superpotentes. Estos imanes son un componente esencial de los nuevos motores eléctricos de alta eficiencia, del tipo que se instala en los coches eléctricos y otras tecnologías de energía limpia. Cada coche híbrido necesita unos cien gramos de disprosio para los imanes de sus motores. Si hubieran de producirse millones de coches cada año (como desearían los fabricantes), se necesitarían cada año centenares de toneladas de este elemento.
El disprosio también se usa como absorbente de neutrones para reactores nucleares así como en lámparas de descarga, en las que los compuestos de disprosio sirven para producir una luz de muy alta intensidad. También se usa en dosímetros de radiactividad, en los que unos cristales de calcio dopados con disprosio brillan tras una exposición a radiaciones ionizantes (como los rayos gamma o los rayos X), y la intensidad del brillo indica la dosis total recibida por la persona que lleva este dispositivo.
NÚMERO ATÓMICO → 67
PESO ATÓMICO → 164,93032
PUNTO DE FUSIÓN → 1461 °C
COLOR → BLANCO PLATEADO
PUNTO DE EBULLICIÓN → 2720 °C
FASE → SÓLIDO
ESTRUCTURA CRISTALINA → HEXAGONAL

El holmio es uno de los lantánidos, un grupo de 15 elementos con propiedades parecidas. Todos los lantánidos tienen propiedades magnéticas inusuales, pero el holmio es excepcional por poseer el «momento magnético»» más alto de todos. El momento magnético es una medida que cuantifica la fuerza que puede ejercer un material magnético. Cuando un material con un momento magnético elevado se coloca en un campo magnético, todos sus átomos se alinean con él, enfocándolo y concentrándolo. De todos los conocidos, el holmio es el que mejor lo hace. Por esta razón, a veces se usa en la fabricación de las «piezas polares», las masas de metal que se colocan en los polos de un imán.
Así se hace en las aplicaciones que requieren un campo magnético muy intenso, como el interior de un escáner de resonancia magnética. Este tipo de escáner funciona sometiendo el cuerpo humano a un campo magnético muy fuerte, que de forma momentánea alinea todos sus átomos. Cuando estos retoman a su posición poco después, emiten energía magnética en forma de radiación, que la máquina enfoca para crear una imagen intema del cuerpo. El holmio se descubrió en 1878 gracias a dos grupos independientes de investigadores, los químicos suizos Jacques-Louis Soret y Marc Delafontaine, y el catedrático de química suizo Per Teodor ClevePer Teodor Cleve Wikipedia. La secuencia del descubrimiento implica a varios otros elementos lantánidos. A principios de la década de 1870 se descubrieron los elementos erbio y terbio escondidos en el interior de muestras de itrio. Más tarde se encontró iterbio dentro de muestras de erbio. Fue en el material residual donde los dos grupos de científicos encontraron pruebas de un nuevo elemento más. SoretJacques-Louis Sorete
Wikipedia. La secuencia del descubrimiento implica a varios otros elementos lantánidos. A principios de la década de 1870 se descubrieron los elementos erbio y terbio escondidos en el interior de muestras de itrio. Más tarde se encontró iterbio dentro de muestras de erbio. Fue en el material residual donde los dos grupos de científicos encontraron pruebas de un nuevo elemento más. SoretJacques-Louis Sorete Wikipedia y DelafontaineMarc Delafontaine
Wikipedia y DelafontaineMarc Delafontaine Wikipedia lo hicieron examinando el espectro de luz emitida por el erbio, en el que encontraron bandas de luz con frecuencias que no coincidían con las propiedades que se conocían del elemento.
Wikipedia lo hicieron examinando el espectro de luz emitida por el erbio, en el que encontraron bandas de luz con frecuencias que no coincidían con las propiedades que se conocían del elemento.
Esto los llevó a especular sobre la existencia de un nuevo elemento, al que llamaron «Elemento X». Cuando Cleve separó una nueva sustancia química del erbio y su espectro de emisión coincidió exactamente con las bandas misteriosas del Elemento X, supo que había dado con el esquivo elemento. No tardó en darle un nuevo nombre: «holmio», por la capital de Suecia, Estocolmo (Stockholm, en sueco).
El holmio solo tiene un isótopo natural, H0-165, que es estable. Existen otros isótopos sintéticos, algunos de ellos radiactivos. El elemento se oxida con rapidez en presencia de humedad y no se encuentra en la naturaleza en su forma pura. Cada año se extraen unas diez toneladas de unos depósitos totales estimados en 400.000 toneladas.
Aparte de su uso en los imanes, el holmio se añade a granates de itrio y hierro en la fabricación de láseres seguros para la vista pero que sin embargo tienen poder de corte suficiente para ser usados en cirugía, odontología y comunicaciones por fibra óptica. Las vistosas tonalidades rojas y amarillas del holmio también lo hacen útil como colorante en la joyería de circonita.
NÚMERO ATÓMICO → 68
PESO ATÓMICO → 167,259
PUNTO DE FUSIÓN → 1362 °C
COLOR → PLATEADO
PUNTO DE EBULLICIÓN → 2868 °C
FASE → SÓLIDO
ESTRUCTURA CRISTALINA → HEXAGONAL

El erbio es otro de los elementos de las «tierras raras» que se extraen de los depósitos del mineral gadolinio cercanos a Ytterby, en el centro este de Suecia. Como otras tierras raras, el erbio recibe su nombre de Ytterby, el pueblo que durante el siglo XIX fue el epicentro de la investigación sobre los elementos químicos fundamentales. Por esta razón, el nombre moderno del grupo es «secuencia de lantánidos». Erbio fue descubierto en 1843 por Carl Gustav Mosander, que fue el primero en extraer su óxido (erbia) de los minerales de Ytterby; como con los otros lantánidos, su tendencia a reaccionar con el oxígeno y el agua hacen que el erbio no se encuentre en la naturaleza en su forma metálica pura. El metal puro de erbio no se produjo hasta 1934, mediante la reacción de una muestra de cloruro de erbio con vapores de potasio. El erbio es uno de los elementos lantánidos más abundantes, con una concentración en la corteza de la Tierra de unos 2,8 mg/kg.
Esto se debe a una peculiaridad en el modo en que se añaden los electrones a medida que aumenta el número atómico. Por ejemplo, el erbio (número atómico 68) tiene un electrón más que el holmio (número atómico 67), pero este electrón se añade a una de las capas internas, lo que significa que el número de electrones de la capa más externa (que es el principal factor que determina las propiedades químicas de un elemento) es el mismo para todos los lantánidos: tres.
Su parecido químico tiende a conferir a los lantánidos propiedades físicas similares. Muchos presentan un comportamiento magnético peculiar y son buenas sustancias para alear con metales y reducir su dureza, haciéndolos más fáciles de trabajar.
Una aplicación excepcional del erbio es en amplificadores de láser para sistemas de comunicaciones por fibra óptica. Por lo general, para incrementar la potencia de un pulso de luz enviado por una fibra óptica se requiere la instalación de un complejo relé que convierta el pulso en una señal electrónica con el fin de amplificarla. Pero si se dopa el vidrio de la fibra con erbio, se consigue que la propia fibra adquiera propiedades parecidas a las del láser, y emita fotones de luz con la misma energía, y que se desplazan en la misma dirección, que los del pulso original.
También tiene usos en medicina. Los láseres basados en erbio emiten luz infrarroja con una longitud de onda de 2,9 micrómetros que el agua absorbe con facilidad, lo que la hace perfecta para aplicaciones quirúrgicas y odontológicas, en las que resulta esencial una pequeña profundidad de corte.
El erbio es una de las pocas sustancias que se pueden usar para fabricar lentes de gafa tintadas de rosa. Casi todas las gafas de lentes rosadas están hechas añadiendo al cristal una pequeña cantidad de óxido de erbio. Este absorbe las tonalidades verdosas de la luz blanca, dejando un color rosado.
NÚMERO ATÓMICO → 69
PESO ATÓMICO → 168,93421
PUNTO DE FUSIÓN → 1545 °C
COLOR → GRIS PLATEADO
PUNTO DE EBULLICIÓN → 1950 °C
FASE → SÓLIDO
ESTRUCTURA CRISTALINA → HEXAGONAL

El tulio fue descubierto en 1879 por Per Teodor Cleve, que consiguió aislarlo como una impureza en muestras de erbio. Cleve le dio nombre en honor de Thule, como antiguamente se conocían las tierras situadas en los márgenes del mundo conocido.
El tulio es uno de los elementos de las «tierras raras», o «lantánidos». Por una peculiaridad química, todos los lantánidos comparten muchas propiedades físicas: son metales blandos y plateados que se oxidan con rapidez en contacto con el aire y que arden a temperaturas relativamente bajas; en el caso del tulio, a 149 °C, mucho menos que los 233 °C del papel. No obstante, la mayoría de ellos también tienen algo especial que los distingue de los otros elementos. Por ejemplo, el erbio es muy útil para amplificar las señales en las comunicaciones por fibra óptica, el neodimio se usa en la fabricación de los imanes más potentes que conocemos, y el gadolinio es un excepcional absorbente de neutrones que se usa para controlar la actividad de los núcleos de los reactores nucleares.
El tulio, sin embargo, no tiene apenas propiedades que lo hagan destacar. Es extraordinariamente raro y difícil de extraer a partir de los minerales que lo contienen, por lo que a nadie se le ocurriría usar tulio por sus propiedades más genéricas cuando otro lantánido podría hacer lo mismo y por mucho menos dinero.
Aun así, no está del todo desprovisto de aplicaciones. Los ingenieros de iluminación usan tulio en la construcción de lámparas de arco de color verde: se utiliza como revestimiento de la bombilla, donde absorbe energía del destello del interior de la lámpara y la vuelve a emitir a las longitudes de onda características de la luz verde. También se usa como dopante (junto al holmio y el cromo) en los láseres YAG para crear un material que emita luz láser apropiada para aplicaciones médicas. Otra aplicación está en los escáneres de rayos X portátiles; el tulio que ha sido expuesto a radiación ionizante en el interior de un reactor nuclear se convierte en una fuente de rayos X.
El tulio se halla en la corteza de la Tierra en la exigua concentración de 0,5 mg/kg. Se encuentra principalmente en la monacita, de la que comprende tan solo un 0.007 %.
La regla de Oddo-HarkinsRegla de Oddo-HarkinsLa regla de Oddo-Harkins sostiene que un elemento con un número atómico par (como el oxígeno: elemento 8) es más abundante que los elementos con números atómicos impares adyacentes más grandes y más pequeños (como nitrógeno: elemento 7 y el flúor: elemento 9). Esta tendencia a la abundancia de elementos químicos fue informada por Giuseppe Oddo en 1914 y William Draper Harkins en 1917. Wikipedia explica su rareza: los elementos con número atómico impar son siempre menos abundantes que los de número atómico impar.
La razón hay que buscarla en la física cuántica. Los protones, las partículas cuyo número dentro del núcleo de un elemento determina su número atómico, tienen una propiedad cuántica denominada «espín» o momento intrínseco de rotación, pero en un sentido muy distinto del cotidiano, pues el espín cuántico solo puede existir en uno de dos estados, designados «arriba» y «abajo». Dos protones con espines opuestos tienden a emparejarse en una configuración más estable. La partícula que queda desparejada en un grupo impar de protones intenta continuamente aparearse, lo que crea en los elementos de número atómico impar una tendencia a aumentar su número atómico en uno, convirtiéndose en elementos pares. En consecuencia, los elementos de número atómico impar son más raros.
NÚMERO ATÓMICO → 70
PESO ATÓMICO → 173,054
PUNTO DE FUSIÓN → 824 °C
COLOR → PLATEADO
PUNTO DE EBULLICIÓN → 1196 °C
FASE → SÓLIDO
ESTRUCTURA CRISTALINA → CÚBICA CENTRADA EN LAS CARAS

Para algunos químicos, el iterbio es el último elemento de la secuencia de los lantánidos, una serie de elementos químicos que comienza con el lantano y prosigue por orden creciente de número atómico. Históricamente se los conocía como «tierras raras», y esta designación incluía el elemento que sigue al iterbio, el lutecio, pero los químicos discuten si este es realmente un lantánido.
El iterbio fue descubierto en 1878 por el químico suizo Jean Charles Galissard de Marignac. El iterbio representa un paso más en el largo y enrevesado camino del descubrimiento de elementos en los minerales hallados cerca de Ytterby. En muchas de las ocasiones en que se descubrió en estos minerales un nuevo elemento (entre ellos el itrio, el erbio, el terbio y el holmio), las muestras obtenidas resultaron estar contaminadas por sustancias que también eran nuevos elementos. En 1843, se extrajeron de muestras de itrio los elementos erbio y terbio. Marignac logró extraer un óxido blanco a partir del erbio, que correctamente coligió que se trataba del óxido de un nuevo elemento. Este recibió el nombre de iterbio por el pueblo de Ytterby. Sin embargo, el iterbio metálico puro no fue aislado de su óxido hasta la década de 1950, con la ayuda de técnicas de intercambio de iones.
En la actualidad disponemos de fuentes de iterbio más copiosas. Probablemente los depósitos naturales más abundantes se encuentren entre los iones absorbidos por arcillas del sur de China, que contienen alrededor de 3 a 4 % de óxido de iterbio. Con una concentración media en la corteza de la Tierra de unos 3 mg/kg, el iterbio es dos veces más común que el estaño. Aun así, es uno de los lantánidos más escasos; no se producen más de 50 toneladas de iterbio al año.
Existen siete isótopos naturales del iterbio, con número de masa de 168,170-174 y 176. Ninguno es radiactivo. Sin embargo, el isótopo sintético Yb-169 es un fuerte emisor de rayos gamma, una forma de radiación ionizante parecida a los rayos X, lo que ha llevado a su uso en máquinas portátiles de rayos X, que tienen aplicaciones en medicina de emergencia (por ejemplo, en hospitales de guerra), y para inspeccionar y diagnosticar fallos en maquinaria demasiado grande para colocarla en un escáner convencional. También se añade al acero inoxidable para mejorar la fuerza del metal, y sirve de dopante en láseres, donde mejora la calidad de la luz emitida.
Los elementos se dividen a grandes rasgos en tres categorías: conductores, aislantes y los que caen en medio, conocidos como semiconductores. El iterbio, sin embargo, parece andar saltando de un lado a otro de esta clasificación. A presión normal, se comporta como un conductor, pero si se comprime hasta 16 000 veces la presión atmosférica, se convierte en semiconductor. Si se sigue aumentando la presión, a 39 000 atmósferas su conductividad desciende en un factor de diez, para luego saltar hasta 10 veces su valor normal cuando se alcanzan las 40 000 atmósferas. Esta propiedad se aprovecha en la construcción de indicadores de presión que operan en condiciones extremas, por ejemplo en el interior de explosiones nucleares.
NÚMERO ATÓMICO → 71
PESO ATÓMICO → 174,9668
PUNTO DE FUSIÓN → 1652 °C
COLOR → PLATEADO
PUNTO DE EBULLICIÓN → 3402 °C
FASE → SÓLIDO
ESTRUCTURA CRISTALINA → HEXAGONAL

Algunos químicos incluyen el lutecio en la serie de lantánidos, mientras que otros lo sitúan entre los metales de transición. Los lantánidos son una secuencia horizontal que se suele sacar del cuerpo principal de la tabla para colocarla al pie y obtener de este modo una disposición más clara y compacta. La casilla de la que se extrae se deja en blanco o se llena con una copia del lantano. Sin embargo, hay quien sostiene que ese espacio debería ocuparlo el lutecio, que de este modo saldría de la secuencia de los lantánidos.
El lutecio es el elemento más duro y denso de la secuencia de los lantánidos, lo cual no es ninguna sorpresa porque, al tener el número atómico más alto, contiene el mayor número de partículas. Sin embargo, hay otra razón. A medida que se asciende por la secuencia de los lantánidos por orden de número atómico, el diámetro de los átomos, paradójicamente, se torna más pequeño.
Este efecto, que se conoce como «contracción de los lantánidos», se debe al hecho de que al aumentar el número atómico aumenta tanto la carga positiva del núcleo como la carga negativa de la nube de electrones que lo rodea. Esto, a su vez, incrementa la fuerza de atracción entre los dos, haciendo que el átomo se encoja. En la mayoría de los átomos los electrones se añaden a la «capa» o nivel orbital más exterior a medida que aumenta el número atómico. Esto sitúa a los electrones lo más lejos posible del núcleo de carga positiva, minimizando la fuerza de atracción. Sin embargo, en los lantánidos, los nuevos electrones se añaden a una capa interna, lo que significa que notan con más fuerza la atracción electromagnética del núcleo; esta es la causa de la contracción en los lantánidos.
El lutecio fue descubierto en 1907 por el químico francés Georges UrbainGeorges Urbain Wikipedia. Fue el paso final de un largo camino de descubrimiento de elementos que comenzó con el itrio en 1787. Como las propiedades de los lantánidos son tan parecidas, mezclados con el itrio se encontraban varios otros elementos nuevos que no fueron detectados hasta años más tarde, como el erbio, el terbio, el tulio y el holmio. Al final, los químicos lograron extraer estos elementos polizones en una cadena de descubrimientos que culminó con el lutecio. Urbain estuvo a punto de no recibir el crédito porque un químico austríaco, Carl Auer von Welsbach, y el americano Charles JamesJames Charles Phillips
Wikipedia. Fue el paso final de un largo camino de descubrimiento de elementos que comenzó con el itrio en 1787. Como las propiedades de los lantánidos son tan parecidas, mezclados con el itrio se encontraban varios otros elementos nuevos que no fueron detectados hasta años más tarde, como el erbio, el terbio, el tulio y el holmio. Al final, los químicos lograron extraer estos elementos polizones en una cadena de descubrimientos que culminó con el lutecio. Urbain estuvo a punto de no recibir el crédito porque un químico austríaco, Carl Auer von Welsbach, y el americano Charles JamesJames Charles Phillips Wikipedia, detectaron el elemento casi al mismo tiempo. James no estaba seguro de su hallazgo y decidió no publicarlo. Sin embargo, Welsbach fue más firme en su pretensión y entre él y Urbain se desató una agria disputa sobre quién había encontrado el lutecio primero. En 1909 se decidió finalmente conceder la prioridad a Urbain.
Wikipedia, detectaron el elemento casi al mismo tiempo. James no estaba seguro de su hallazgo y decidió no publicarlo. Sin embargo, Welsbach fue más firme en su pretensión y entre él y Urbain se desató una agria disputa sobre quién había encontrado el lutecio primero. En 1909 se decidió finalmente conceder la prioridad a Urbain.
Durante muchos años, el lutecio fue el elemento químico más caro de toda la tabla periódica, llegando a alcanzar 75 000 dólares por kilogramo, seis veces más que el oro. Métodos más eficaces para aislarlo de los minerales que lo contienen han redundado ahora en un precio más modesto, de 10 000 dólares por kilogramo. La producción anual se sitúa alrededor de 10 toneladas.
El lutecio tiene aplicaciones médicas como material detector en los escáneres de tomografía por emisión de positrones, mientras que el isótopo Lu-176 se usa en radioterapia.
97304